
- Что такое физика? Что изучает физика?
- Атомно-молекулярное строение вещества. Броуновское движение.
- Агрегатные состояния вещества
Что такое физика? Что изучает физика?
Перед тем как говорить о физике, давайте вспомним другие более знакомые и привычные нам предметы.
Математика - царица наук, она работает с цифрами, с переменными, с уравнениями. Это наука о том, как можно взять какое-то число, какое-то выражение и посчитать его. То есть математика развивается в сторону того, чтобы уметь почитать абсолютно любое выражение, и чтобы каждый человек смог применить те или иные формулы.
Биология - это наука, которая изучает всё живое, живые одноклеточные и многоклеточные организмы, она использует при этом различные методы измерения и измерительные приборы. Она изучает мир вокруг нас.
Химия - это наука о превращении одного вещества в другое.
География и археология - это науки, изучающие поверхность Земли и связанные процессы.
Также существует много других наук: информатика, астрономия, история, экономика, музыка. Но к чему все это?
Дело в том, что физика - это наука о каждой из этих перечисленных наук.
Физика - это наука о каждом предмете, о каждом процессе, о каждом явлении в вашей жизни.
Физика объясняют абсолютно всё: как мы дышим, почему мы дышим, чем мы дышим, как мы говорим, почему мы слышим и т.д.
Физика очень интересна, увлекательна, в ней очень много загадок и тайн, которые ждут своего открытия.
Атомно-молекулярное строение вещества. Броуновское движение.
Наблюдая за миром вокруг нас, мы вполне можем предположить, что любой предмет можно разделить на несколько частей равных или неравных.
Ученые физики проделали множество опытов и поняли, что каждая материя состоит из маленьких «кирпичиков». Эти кирпичики называются молекулами.
Если мы представим себе ткацкий станок и много-много ниточек переплетенных между собой, они, переплетаясь, образуют целое полотно. Молекулы также собираются вместе и образуют материю.
Каждое вещество состоит из молекул, благодаря этому, мы можем разделять эти молекулы, соединять, а вещество будет менять свой размер и даже форму.
Демокрит, который жил в 460-370 гг до нашей эры, считал, что абсолютно любое тело состоит из маленьких частичек. На тот момент времени его предположения напоминали фантастику.
Лишь в семнадцатом веке нашей эры Михаил Васильевич Ломоносов подвел научное обоснование этой теории. В своих трудах он дал такое определение мельчайшим частичкам:
- Каждое тело состоит из корпускул. Такое наименование Ломоносов дал молекулам.
- Любая корпускула состоит из атомов.
- Атомы и корпускулы постоянно передвигаются.
- При объединении идентичных атомов происходит образование корпускулы простейших веществ.
- При объединении разных атомов образуются корпускулы сложных веществ.
Ученый из Англии Джон Дальтон развил в своих работах тему о строении вещества. Основной целью Дальтона было определение величины массы атома.
Английский ученый говорил о своих взглядах на мельчайшие частицы. Он считал, что каждое тело состоит лишь из атомов, которые объединяются в сложные структуры.
Огромный вклад внесли британские физики Майкл Фарадей и Джеймс Клерк Максвелл. Фарадей объяснил электролиз, а Максвелл оценил средний пробег молекул газа и заложил основы статистической механики.
Новая веха развития в физике стартовала в девятнадцатом веке, когда теория атомно-молекулярного строения вещества стала носить официальный статус.
Атом в свою очередь можно разделить еще на более мелкие частицы. Он состоит из протонов, нейтронов и электронов. Они все взаимодействуют друг с другом, отталкиваются, притягиваются, образуют связи.
Все частицы вещества находятся в постоянном движении, которое невозможно обнаружить прямым наблюдением в лупу или микроскоп. Но увидеть это можно косвенным образом по результату действия этих частиц на другие видимые предметы или частицы.
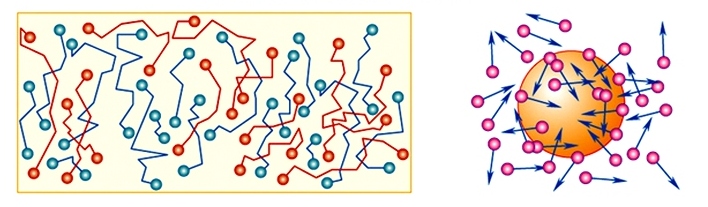
Впервые такое действие наблюдал английский ботаник Роберт Браун. Под микроскопом частички спор растений хаотично перемещались в воде без видимых на то причин.
На самом деле хаотично перемещаются молекулы воды, а перемещение пыльцы в чаше, которое наблюдал Броун, является результатом соударения частиц с молекулами воды.
В честь Роберта Брауна такое движение молекул в веществе и было названо «броуновским движением».
Атомно-молекулярное строение
Молекула представляет собой мельчайшую частичку, которая обладает химическими свойствами данного элемента. Расположение мельчайших частичек определяет строение вещества. Любая молекула состоит из атомов. Характеристика вещества определяется благодаря составу атомов.
В любой атом входит:
- Положительно заряженное ядро.
- Отрицательные электроны, которые вращаются вокруг положительно заряженного ядра.
Опыты и исследования показали, что вес молекул варьируется в пределах 10-23—10-26 килограмм. Величина является настолько маленькой, что рассмотреть мельчайшую частицу можно лишь при помощи электронного микроскопа. Наименование «молекула» с латыни переводится как «маленькая масса».
Любое вещество имеет собственное обозначение. К примеру, кислород обозначается буквой латинского алфавита – О, а водород – Н. По этой причине молекула воды имеет следующую химическую формулу: H2O. Данная формула показывает, что в молекуле располагается 2 атома водорода и лишь 1 атом кислорода.
Размеры молекул - d = 0,000001мм = 0,000000001м = 10⁻⁹м = 1 нм.
Одна капелька воды содержит в себе столько молекул, сколько таких же капелек находится в Черном море.
Интересный факт: если небольшой кусок сахара бросить в Черное море (глубина – один километр, площадь – четыреста тысяч квадратных метров), то после его полного растворения в ведре воды это моря будет 100 молекул сахара.
Каждая молекула имеет уникальное свойство – абсолютная идентичность при принадлежности к одному веществу. Учеными было доказано, что молекулы одного и того же тела – одинаковы, иными словами, вода, водяной пар и лед имеют идентичный молекулярный состав.
Агрегатные состояния вещества
Главный принцип – любое вещество состоит из мельчайших частиц, находящихся на различных расстояниях друг от друга. Иными словами, между каждой молекулой имеются промежутки. Величина промежутка напрямую зависит от агрегатного состояния вещества.
Существует два опытных обоснования этому принципу:
- Деформация – изменение объема и формы веществ.
- Разрушение тел.
То, что элементарные частицы находятся в постоянном хаотичном движении, было доказано следующими опытными обоснованиями:
- Броуновское движение.
- Диффузия веществ.
- Испарение веществ.
- Давление газа.
Диффузией является взаимное проникновение молекул 1-ого вещества между молекулами 2-ого.
Диффузия в газах происходит быстро (минуты), жидкостях – медленно (минуты-часы), твердых веществах – очень долго (несколько лет). Скорость диффузии напрямую зависит от скорости движения элементарных частиц, то есть от температуры.
То, что частицы какого-либо вещества взаимодействуют друг с другом (притяжение и отталкивание), было доказано следующими опытными обоснованиями:
- Смачивание и не смачивание. Если жидкость смачивает твердое вещество, то молекулы жидкости притягиваются между собой более слабо, чем к молекулам вещества. При несмачиваемости, наоборот, молекулы жидкости имеют более сильное притяжение друг к другу, чем к молекулам твердого вещества.
- Упругость тел, к которым относятся сохранение формы твердых веществ и наличие расстояния между элементарными частицами.
- Слипание тел с разнообразными отшлифованными поверхностями.
Между молекулами существует взаимное притяжение. Любая молекула притягивает к себе каждую соседнюю молекулу, и сама притягивается ими.
При разрыве нити, ломании палочки или же отрывании частички бумаги происходит преодоление сил притяжения между молекулами.
Увидеть притяжение между 2-умя молекулами невозможно. При притяжении множества миллионов таких элементарных частиц взаимное притяжение становится значительным. По этой причине трудно разорвать руками крепкую веревку и невозможно поломать металлическую балку.
Заметить притяжение между молекулами можно только тогда, когда они располагаются близко друг к другу. Ослабевание происходит на расстоянии, которое превышает габариты самих молекул. Две капельки воды сливаются в одну при соприкосновении. 2 цилиндра из свинца сцепляются в один при плотном прижатии друг к другу ровными поверхностями. Такое сцепление может быть настолько крепким, что свинцовые цилиндры не получится оторвать друг от друга даже при сильнейшей нагрузке.
Стеклянные осколки, наоборот, невозможно соединить при плотном прижатии. Из-за неровностей не получится сблизить их на необходимое расстояние, на котором частички способны быть притянуты друг к другу. Однако, при размягчении стекла путем нагревания, появляется возможность спаивания стекла. Это говорит, что частицы вещества оказались на нужном для действия притяжения расстоянии.
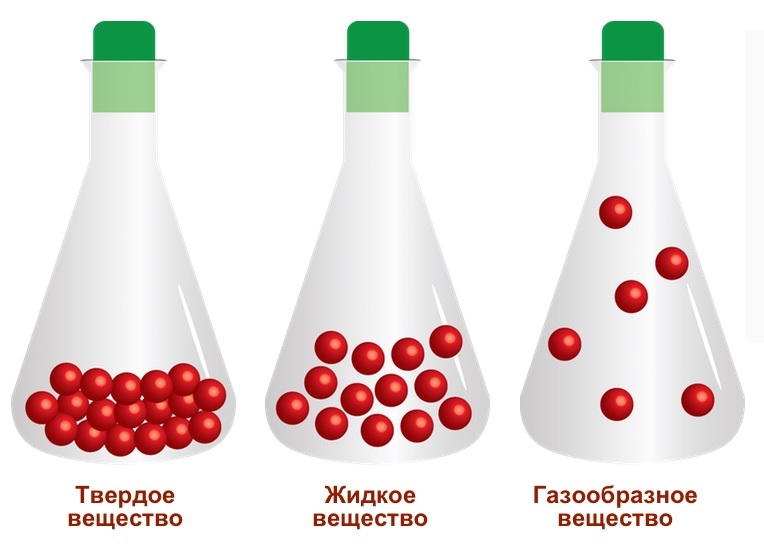
Существует три основных агрегатных состояния вещества: твёрдое, жидкое и газообразное.
Как они различаются и чем они похожи?
Для наглядности рассмотрим информацию об агрегатных состояниях вещества в табличной форме:
| Агрегатное состояние | Нахождение молекул в пространстве | Характеристики движения | Промежутки между молекулами | Свойства |
| Твердое | Имеется конкретный порядок | Происходит колебание без передвижения | Небольшие, не превышающие диаметр молекулы | Сохранение объема. Имеют собственную форму. Малая сжимаемость. |
| Жидкое | Хаотическое | Происходят колебания с передвижением | Маленькие, меньшие размера молекулы | Сохранение объема без сохранения формы. Принимают форму сосуда. Малая сжимаемость и текучесть. |
| Газообразное | Хаотическое | Постоянное передвижение и удары | Огромное расстояние, на отрезке которого может находиться большое количество молекул | Отсутствие постоянной формы и объема. Сжимаемость. Неограниченное расширение с заполнением всего предоставленного объема. |
Вещества встречаются во всех 3-х агрегатных состояниях. Каждое состояние обладает собственными свойствами и характеристиками.
Все мы знаем, что все вещества состоят из молекул. Молекул в каждом веществе находятся на разных расстояниях и в разных состояниях. В зависимости от этого вещество обладает какими-то свойствами.
Твердые вещества мы можем взять в руку, потрогать, и они не изменят свою форму. Связано это с характерным внутренним строением: молекулы в твердых веществах располагаются в строгом порядке. Учёные называют этот «порядок» кристаллической решеткой. В твердом веществе все молекулы жёстко связаны друг с другом.
Существует две группы, на которые подразделяются все твердые вещества:
- Кристаллические. Здесь местонахождение молекул идет по конкретной схеме.
- Аморфные. Расположение элементарных частиц происходит в хаотическом порядке. Отсутствует конкретная структура.
Кристаллические твердые вещества подразделяются на следующие четыре типа:
- Атомные. Элементарные частицы имеют прочную связь между собой. В результате тела имеют высокую прочность. Один из ярких примеров – алмаз.
- Молекулярные. Ослабленная связь между элементарными частицами. В итоге вещества обладают высокой подверженностью к плавлению. Яркий пример – сахар.
- Ионные. В этих телах располагаются отрицательно и положительно заряженные частицы. Связь между ними осуществляется благодаря электростатическому притяжению. К данным веществам относятся различные щелочи и кислоты, которые легко растворяются в воде.
- Металлические. В этих веществах находятся положительные ионы, между которыми свободно передвигаются отрицательные электроны. Эти вещества отлично проводят теплоэнергию и электроток.
Из-за того, что в структуре кристаллического строения вещества располагается малое число потенциальной энергии, она относится к устойчивой.

В жидком веществе молекул значительно меньше, они находятся рядом друг с другом, но постоянно перемещаются и сталкиваются. Отделить эти молекулы одну от другой значительно проще.
Молекула жидкого тела не имеют такой же четкой структуры, как в твердых веществах. Здесь расположение молекул находится на близком расстоянии. Промежутки между элементарными частицами являются постоянной величиной. Это происходит благодаря высоким показателям молекулярной связи. Стоит заметить, что силы связи не хватает, чтобы молекулы имели статическое положение на протяжении продолжительного временного промежутка. В итоге происходит передвижение молекул в другие места. Всё это приводит к тому, что жидкое тело имеет свойство текучести.
Вода – это самая распространенная жидкость на планете.
К основным разновидностям жидких тел относятся:
- Атомарные. Они состоят из сферических молекул и атомов. Яркий пример – метан.
- Ассоциированные. Между элементарными частицами находятся связи водорода. Сюда относится вода.
- Полярные. В состав этого типа входят полярные молекулы. Сюда можно отнести жидкий бромводород.
- Двухатомные. Разновидность, состоящая из 2-ух идентичных атомов. В виде примеров можно привести жидкий водород или же ртуть.
Жидкие тела имеют способность растворения в себе определенных веществ благодаря характеристикам внутренней структуры.
В газообразном веществе расстояние между молекулами значительно больше, чем в жидком. Молекулы почти не связаны друг с другом, они занимают весь предоставленный им объем и перемещаются в разных направлениях на большой скорости.
Молекулы газообразного вещества находятся на большом расстоянии друг от друга. В итоге между ними отсутствует какое-либо взаимодействие. При помещении газа в закрытую ёмкость произойдет быстрое его распространение по всему объему. Газообразные вещества легко сжимаются из-за серьезного расстояния между элементарными частицами.
Определенные вещества имеют возможность перехода из 1-го агрегатного состояния в другое. Пример – обычная вода при испарении становится газом. Этот процесс быстро реализуется при кипячении воды. Во время кипячения, от воды происходит отсоединение некоторых молекул, большая часть которых осуществляет формирование пара.
Имеются и твердые вещества, которые растворяются в жидкости. Сюда можно отнести соль или же сахар. Все это реализуется из-за молекул, переходящих в другие состояния.
Зная информацию о строении вещества можно дать объяснение различным физическим явлениям. К примеру, почему вода в чайнике выкипает, а ее количество становится меньше. Это происходит из-за испарения молекул воды при нагреве и дальнейшем переходе в газообразное агрегатное состояние. Поэтому их число в чайнике постепенно убавляется и происходит уменьшение объема воды.
Можно дать ответ на вопрос: «Почему происходит снашивание и уменьшение подошвы на обуви?». При трении о какую-либо поверхность некоторое количество молекул остается на поверхности, а их число на самой подошве уменьшается.
Эти знания помогают разрабатывать новые материалы с необходимыми заданными характеристиками и свойствами.
Рассматривая любое вещество, которое находится в определенном агрегатном состоянии, стоит знать, что ее основой являются такие мельчайшие частицы, как атомы и молекулы. В зависимости от расположения этих частиц в пространстве любое тело получает присущие ему индивидуальные характеристики и свойства.



Добавить комментарий